医学研究所
研究内容とその特色、業績
医学研究所では、フローサイトメトリーによる細胞分析、染色体・遺伝子検査、電子顕微鏡による超微細構造の観察などを駆使して、造血器腫瘍の診断と治療を支援しています。
以下の研究成果は、天理よろづ相談所病院 血液内科、臨床検査科、病理診断部などとの共同研究で得られたものです。
末梢血マルチカラー・フローサイトメトリーと血漿セルフリーDNAのRHOAG17V/IDH2R172変異解析を組み合わせた血管免疫芽球性T細胞リンパ腫のリキッドバイオプシー診断
血管免疫芽球性T細胞リンパ腫(AITL)はT細胞リンパ腫のなかでは頻度の高い病型です。リンパ腫病変は、リンパ腫細胞だけでなく多彩な反応性細胞から構成されるので、病理診断がときに困難です。近年の研究によって、AITLは濾胞ヘルパーT細胞に由来すること、RHOAG17V遺伝子変異やIDH2R172遺伝子変異が高頻度に認められることが明らかになりました。
我々は20人のAITL患者さんからいただいた末梢血から、白血球・単核球とセルフリーDNAを分離しました。まず、白血球・単核球中に混在するリンパ腫細胞を定量的に評価するために、2種類の抗体パネルを用いた2ステップの10色マルチカラー・フローサイトメトリー法を構築しました。本法を20例に適用したところ全例でリンパ腫細胞を検出し、末梢血白血球に占めるリンパ腫細胞の割合は0.01~18.22%(中央値0.26%)、1マイクロリットルあたりの腫瘍細胞の絶対数は0.5~1491.6個(中央値29.3個)でした。次にRHOAG17V遺伝子変異とIDH2R172遺伝子変異を高感度に検出するallele-specific(AS)-PCR法を開発し20例のセルフリーDNAに適用したところ、RHOAG17V変異は14例(70%)、IDH2R172変異は3例(15%)(RHOAG17V変異例と重複)で認め、6例(30%)は変異陰性でした。これらの結果は、リンパ節、末梢血単核球、骨髄、腹水などの結果と一致しました。従って、末梢血のフローサイトメトリーとセルフリーDNAの変異解析を組み合わせたリキッドバイオプシー診断はAITLの迅速な非侵襲的診断法であることが証明されました。つまり数ミリリットルの末梢血があればAITLを診断することが可能です。
我々はこれらの結果を血液専門誌Leukemia&Lymphoma誌(Leuk Lymphoma 2020;61:2389-2398. DOI:https://doi.org/10.1080/10428194.2020.1768382)に論文発表し、2020年8月に開催された第60回リンパ網内系学会総会で学会発表しました。学会発表では優秀演題に選ばれました。
t(9;14)(p13;q32)転座びまん性大細胞型B細胞リンパ腫の病態
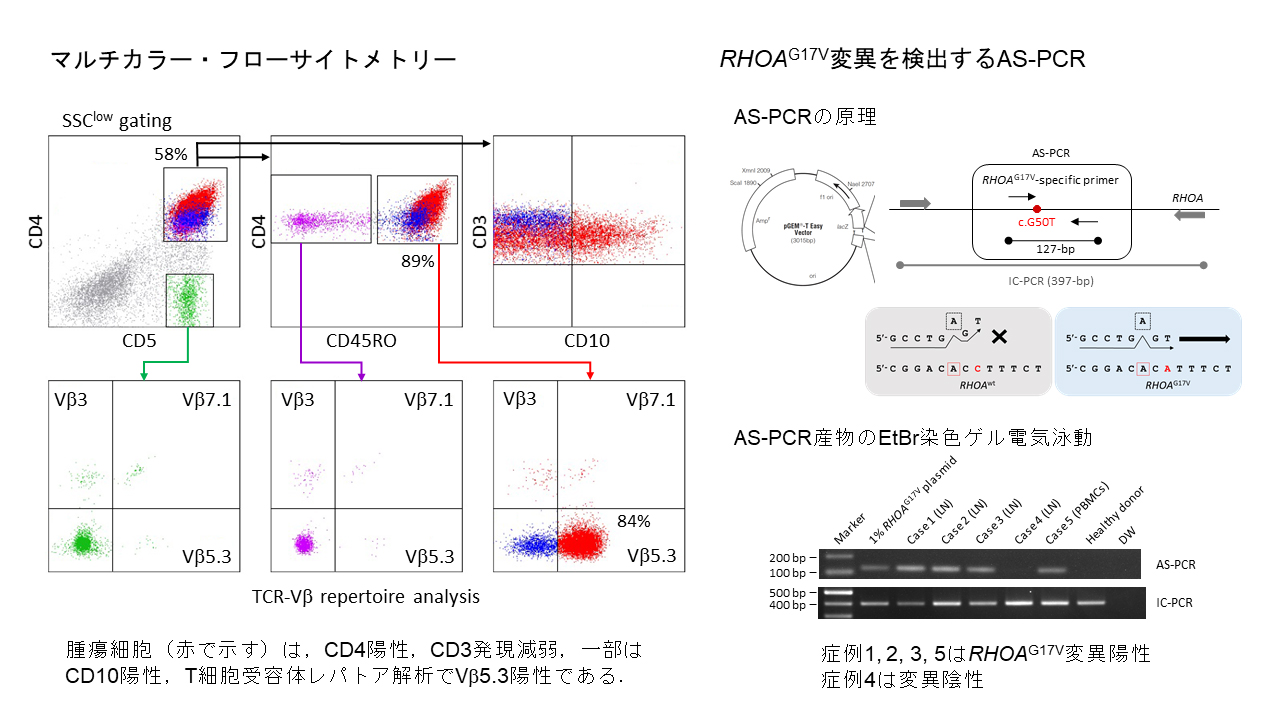
悪性リンパ腫では、病型に特異的な染色体転座が認められます。たとえば、t(14;18)(q32;q21)転座は濾胞性リンパ腫、t(11;14)(q13;q32)転座はマントル細胞リンパ腫、t(8;14)(q24;q32)転座はバーキットリンパ腫を代表とする高悪性度リンパ腫と関連しています。
t(9;14)(p13;q32)転座は、頻度は低いものの、びまん性大細胞型B細胞リンパ腫の一部の症例に認められます。転座の結果、9番染色体p13バンドのPAX5遺伝子が14番染色体q32バンドの免疫グロブリン重鎖遺伝子(IGH遺伝子)と再構成し、PAX5蛋白の発現が亢進します。当院では、1996年から2021年の間にt(9;14)(p13;q32)転座びまん性大細胞型B細胞リンパ腫の患者さんを6人診療しました。年齢は63~80歳、男女比3/3。1例は節性、残り5例は節外臓器(肝、胃、肺、副腎、回盲部、精巣、椎体)に発症、骨髄浸潤は2例に認めました。病期はⅠE期1例、ⅡE期1例、Ⅲ期1例、Ⅳ期3例。IPIスコアは1点1例、2点2例、4/5点3例。リンパ腫細胞は5例で免疫芽球様の形態を示し、Hans分類ではnon-GCB/ABCが5例、GCBが1例、全例でPAX5とMUM1陽性、Ki-67陽性指数は60~>95%でした。G-bandingでt(9;14)(p13;q32)を全例で認め、4例でPAX5 break-apart probeによるFISHで転座を確認しました。3例でPAX5-IGH融合遺伝子をPCR増幅し、3例でMYD88L265P変異を認めました。3例でR-CHOP療法、2例で外科切除+R-CHOP療法を実施し、3例が2年以上無病生存しています。以上の結果から、t(9;14)(p13;q32)転座びまん性大細胞型B細胞リンパ腫は、節性・節外性・播種性に発症し、主としてnon-GCB/ABC形質を示し、PAX5/MUM1陽性を特徴とすることと、標準化学療法のR-CHOP療法で長期生存が期待できることが明らかになりました。
これらの結果の一部は血液腫瘍専門誌Hematological Oncology誌(Hematol Oncol 2020;38:171-80. DOI:https://doi.org/10.1002/hon.2716に論文発表しました。
骨髄異性性症候群(MDS)に合併する肺胞蛋白症のマクロファージはMDSクローンに由来する
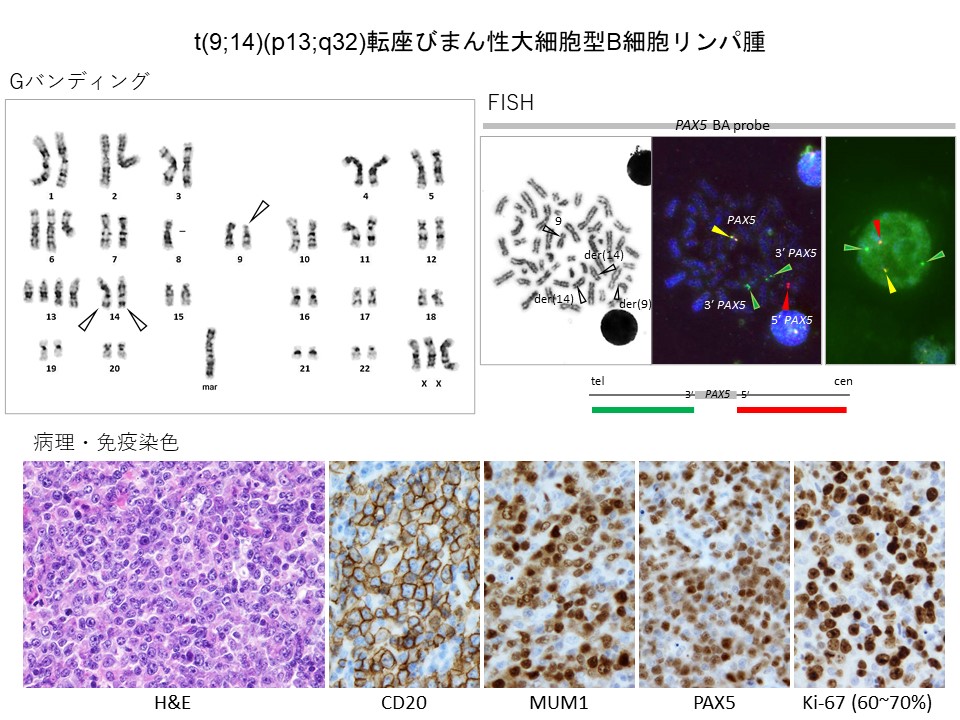
MDSは造血幹細胞のクローン性の疾患で、血球減少を主な兆候としますが、時に肺胞蛋白症を合併することがあります。
下図のaは、あるMDS患者さんの骨髄から得られた染色体標本にTCF3/PBX1プローブをハイブリダイズしたFISHで、PBX1の赤のシグナルがder(1)染色体上で3つ連続しているのがわかります。間期核では、赤のシグナルが4個、緑のシグナルが2個認められます。
bは、この患者さんの肺胞洗浄液のギムザ染色標本です。矢印で示した無構造の物質が認められ、肺胞蛋白症に合致します。一方、細胞成分はリンパ球と肺胞マクロファージです。
下段のcからfは、この標本にTCF3/PBX1プローブをハイブリダイズしたFISHです。リンパ球(Ly)の核は赤2緑2のパターンですが、マクロファージ(MΦ)の核は赤4緑2個のパターンを示し、3個の赤が近接しています。つまり肺胞マクロファージは骨髄のMDSクローン由来であることがわかりました。
従って、MDS患者さんの肺胞マクロファージはMDSクローン由来であるために機能が悪く、肺胞サーファクタントのクリアランスが低下するために肺胞蛋白症の発症に至るという仮説が成り立ちます。この患者さんは非血縁者間同種骨髄移植を受けました。これらの貴重な結果はドイツの血液専門誌に掲載されました(Ann Hematol, 2017;96:2141-2143. DOI:https://doi.org/10.1007/s00277-017-3118-3)。
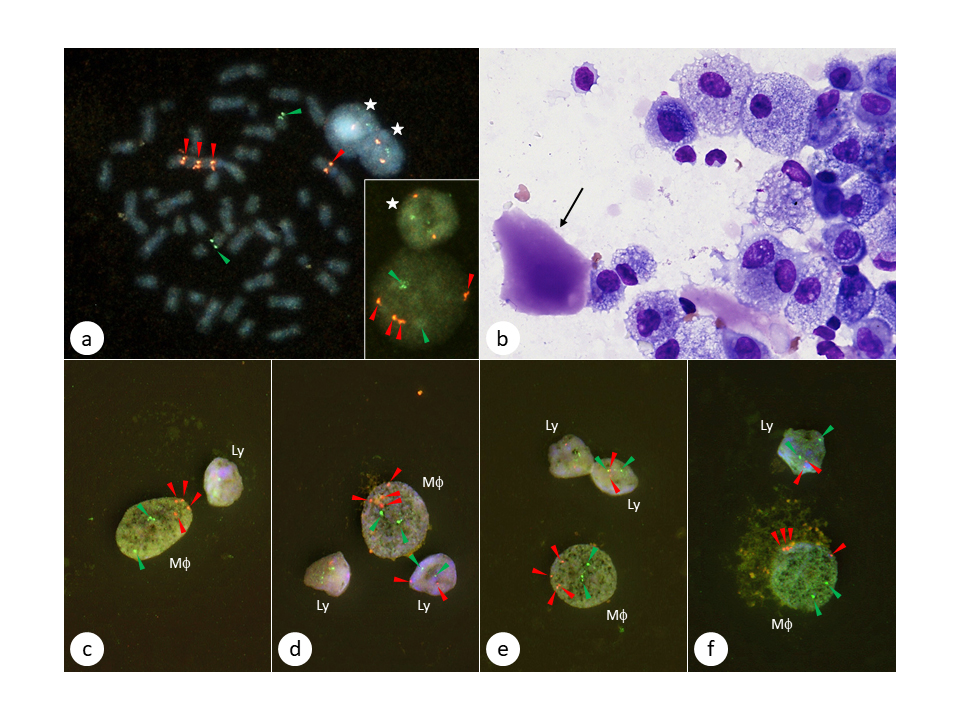
フィラデルフィア(Ph)染色体陽性急性リンパ芽球性白血病(ALL)は、分葉核球のBCR-ABL FISHの結果によって予後の異なる2群に分けられる
Ph染色体は慢性骨髄性白血病(CML)だけでなく成人ALLの一部にも認められますが、Ph陽性ALLにはCMLの急性転化症例が含まれているのではないかと考えられます。我々は急性転化ALLを区別するために、単核の白血病細胞だけでなく分葉核球にもBCR-ABLキメラ遺伝子があるかどうかをFISHで調べました。20例のPh陽性ALL症例を調べた結果、9例が分葉核FISH陽性、残りの11例は陰性でした。つまり、約半数はCMLの急性転化である可能性が示唆されました。
次に、20例のうち18例はチロシンキナーゼ阻害剤単独または多剤併用化学療法による治療を受けたのですが、分葉核FISH陽性症例は陰性症例と比較して、無増悪生存と全生存が優れていることを見出しました。我々はこれらの結果をスイスの血液専門誌Acta Haematologicaに論文発表しました(Acta Haematol, 2016;136:157-166. DOI:https://doi.org/10.1159/000445972)。なお、下図のFISHの写真が同誌の表紙を飾りました。
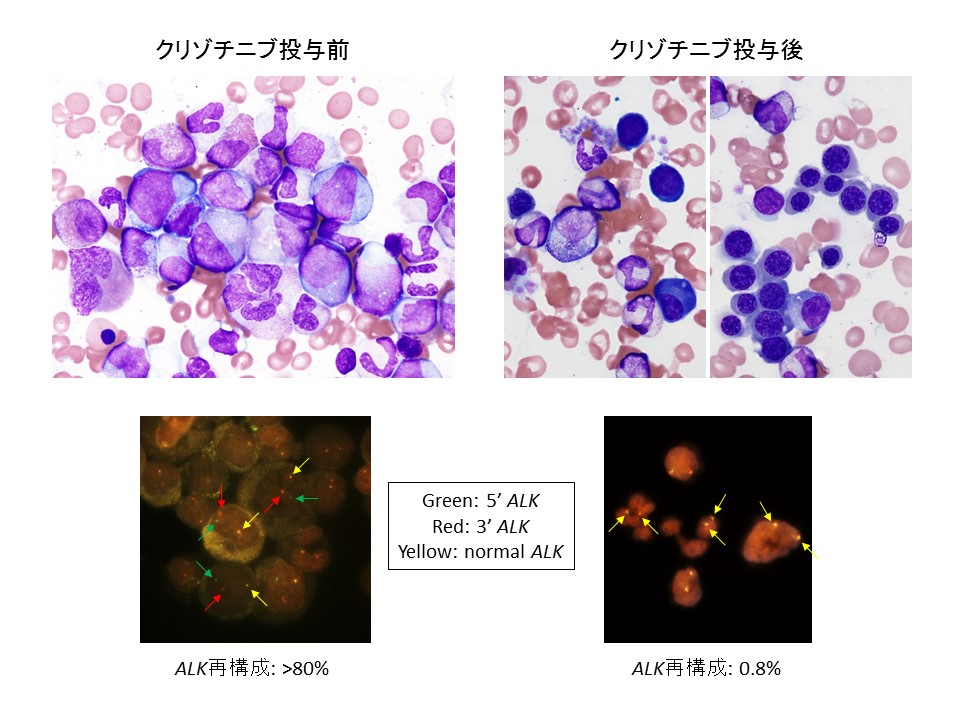
RANBP2-ALK急性骨髄性白血病の診断と治療
我々は、ある急性骨髄性白血病の患者さんの白血病細胞の染色体を分析したところinv(2)(p23q13)という染色体異常を認め、この染色体異常によってRANBP2-ALKキメラ蛋白が産生されていることを見出しました(Int J Hematol, 2014;99:202-207. DOI:https://doi.org/10.1007/s12185-013-1482-x)。
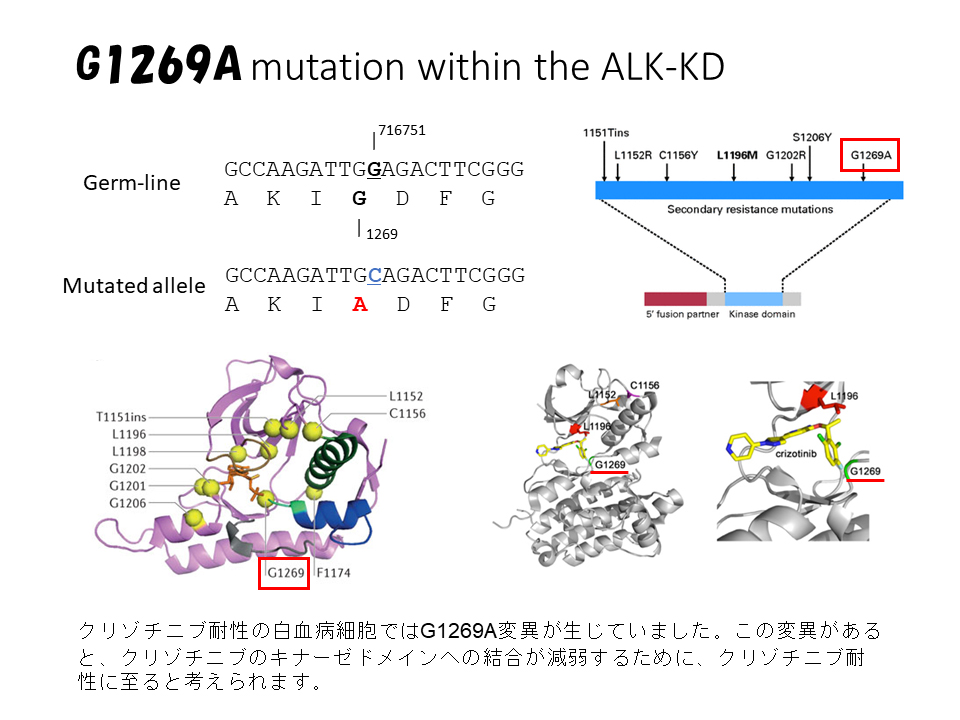
類似の異常は肺癌の一部にも認められ、ALK蛋白のキナーゼドメインを標的としたクリゾチニブという分子標的治療薬がすでに承認されていましたが、急性骨髄性白血病には未承認でした。そこで我々は、病院の倫理委員会の承認と患者さん・ご家族の書面による同意を得たうえで、この患者さんにクリゾチニブを投与しました。その結果、白血病細胞は速やかに減少し、投与開始3ヶ月後には完全寛解状態に至りました。治療開始前には赤血球と血小板の輸血が必要でしたが、治療開始後には輸血の必要もなくなりました。骨髄では白血病細胞が著減し、正常の造血細胞が回復していました。しかし、間もなくALK蛋白のキナーゼドメインに遺伝子変異が生じ、クリゾチニブ耐性になりました。
我々は、これらの治療経過を、第73回日本癌学会学術集会と第76回日本血液学会学術集会で発表し、海外の専門誌に論文発表しました(Leukemia, 2014;28:1935-1937. DOI:https://doi.org/10.1038/leu.2014.166;Cancer Genet, 2015;208:85-90. DOI:https://doi.org/10.1016/j.cancergen.2015.01.003)。

 ホーム
ホーム